16 février 2021
2
16
/02
/février
/2021
18:26
réaction de Diels-Alder
polyène + polyène vers cyclène
C'est une réaction chimique dans laquelle un alcène (diénophile) s'additionne à un diène conjugué pour former un dérivé du cyclohexène.
La règle d'Alder permet de préciser les conditions qui facilitent la réalisation de ces cycloadditions : la réaction s'effectue plus facilement entre un diène riche en électrons et un diénophile pauvre en électrons.
En d'autres termes, un « bon » diène est substitué par des atomes ou des groupes d'atomes donneurs d'électrons, un « bon » diénophile par des atomes ou groupes d'atomes attracteurs (accepteurs) d'électrons.
Ces caractères, attracteurs ou donneurs, peuvent être des effets inductif, mésomère, ou d'hyperconjugaison.
Les alcynes substitués par des groupements attracteurs sont de bons diénophiles. En effet, la réaction d'un éthyne substitué avec 2 groupements attracteurs (par ex, CH3OOC)-C≡C-(COOCH3) avec le buta-1,3-diène donne une réaction possible.
|
Otto Diels
(1876 - 1954)

|
Kurt Alder
(1902 - 1958)

|
Published by jeanlouis.migot
-
dans
théorie
16 février 2021
2
16
/02
/février
/2021
18:17
réaction de Curtius
réaction de réarrangement
azoture amide vers alkyl-isocyanate
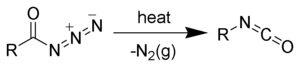

C'est un processus à deux étapes, la première étant la perte de diazote gazeux formant un nitrène d'acyle (2), la seconde un réarrangement du nitrène d'acyle par migration du groupe R pour former l'isocyanate désiré (3).
Cependant, des éléments récents tendraient à prouver que les deux étapes sont concertées, aucun intermédiaire nitrène libre ne se formant.
Theodor Curtius
(1857 - 1928)

Published by jeanlouis.migot
-
dans
théorie
16 février 2021
2
16
/02
/février
/2021
11:41
Published by jeanlouis.migot
-
dans
théorie
15 février 2021
1
15
/02
/février
/2021
18:37
réaction de Favorskii
aldéhyde ou cétone + alcyne vers alcyne-alcool
Lorsque le carbonyle est un aldéhyde (R"=H), un réarrangement se produit et conduit et transforme l'alcyne-alcool en une énone.
Lorsque ce réarrangement est catalysé par un acide, il s'appelle le réarrangement de Meyer–Schuster.
Alexey Yevgrafovich Favorskii
(1860 - 1945)

Published by jeanlouis.migot
-
dans
théorie
15 février 2021
1
15
/02
/février
/2021
12:20
Published by jeanlouis.migot
-
dans
théorie
8 juin 2020
1
08
/06
/juin
/2020
15:06
réaction de Wittig-Horner - 1958
(Georg Wittig: voir Théorie -32)
Leopold Horner (1911 - 2005)

Published by jeanlouis.migot
-
dans
théorie
27 mai 2020
3
27
/05
/mai
/2020
15:01
Emil Knoevenagel
1865 - 1921

Published by jeanlouis.migot
-
dans
théorie
15 mai 2020
5
15
/05
/mai
/2020
13:29
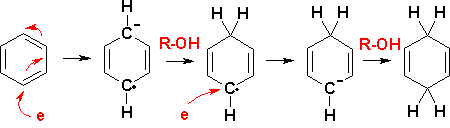
réaction d'Eschweiler-Clarke
1905 et 1933
amination réductrice
Wilhelm Eschweiler 1860 - 1936 et Hans Thatcher Clarke 1887 - 1972
Cette réaction, aussi appelée méthylation d'Eschweiler-Clarke, est une réaction d'amination réductrice par laquelle une amine primaire ou secondaire est méthylée par un excès d'acide méthanoïque (ou formique) et de méthanal (ou formaldéhyde).

Published by jeanlouis.migot
-
dans
théorie
6 mai 2020
3
06
/05
/mai
/2020
13:50
réaction de Brown

Herbert - Charles Brown
1912 - 2004
Prix Nobel de Chimie 1979
Published by jeanlouis.migot
-
dans
théorie
6 mai 2020
3
06
/05
/mai
/2020
13:39
réarrangement de Beckmann
1886

Ernst - Otto Beckmann
1853 - 1923
Published by jeanlouis.migot
-
dans
théorie




/image%2F0994837%2F20210216%2Fob_c1ae3a_img859.jpg)


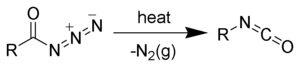


/image%2F0994837%2F20210216%2Fob_0375b2_img858.jpg)


/image%2F0994837%2F20210216%2Fob_39ac3f_img857.jpg)


/image%2F0994837%2F20210215%2Fob_a357cd_img856.jpg)
/image%2F0994837%2F20210215%2Fob_7c999e_img853.jpg)





/image%2F0994837%2F20210215%2Fob_80dba4_img855.jpg)



